borato del gerstley
Objetivo: La substitución del borato Gerstley.
Cuando tratamos de “rehacer” el borato Gerstley a partir de materias primas que se consiguen facilmente en el mercado,
es necesario disponer de la fórmula química del borato Gerstley.
Un artículo de Digitalfire proporciona un cierto número de composiciones diferentes del borato Gerstley.
En mis experimentos para rehacer el borato Gerstley, yo calculé el promedio de esos valores para obtener una única fórmula
química. (que llamé GB RR)
El análisis químico se da en % de peso y al principio se recalcula a fórmula Seger
(la pérdida de agua y la formación de gas CO2-LOI = lost of ignition (pérdida en la quema)- se tiene en cuenta para el
peso molecular.)
| Na2O | K2O | MgO | CaO | Al2O3 | B2O3 | Fe2O3 | SiO2 | LOI | molweight |
| GB De Peso % | 4.5 | .5 | 4 | 24 | 1.5 | 25 | .5 | 12 | 28 |
|
| GB Seger | .12 | .01 | .16 | .72 | .02 | .59 | .01 | .33 |
| 165 |
| GB RR | .12 |
| .16 | .72 |
| .59 |
| .33 |
| 165 |
Como punto de partida se utilizaron los cálculos y los experimentos para “rehacer” el borato Gerstley, pero el
propósito real es conseguir una receta útil de Raku para el alfarero.
Los experimentos son expuestos en orden de ejecución y aunque quizás esto no es lo mejor desde un punto de vista didáctico,
las recetas finales son, afortunadamente, muy simples.
En un vidriado de Raku el borato Gerstley no se usa nunca sólo, sino en combinación con otras materias primas
como la nefelina sienita en proporción de 1:1.
Los cálculos han sido efectuados con el programa alchemistglaze, una hoja
de cálculo “casera” del programa excel 2000. (Se puede conseguir gratis la hoja de cálculo tras rellenar un formulario de
petición. click aquí )
Materiales utilizados y su fórmula química.
| Nombre | peso mol | Na2O | K2O | MgO | CaO | ZnO | Al2O3 | B2O3 | SiO2 |
| Borato Gerstley RR | 165 | .12 |
| .16 | .72 |
|
| .59 | .33 |
| Frita 1451 | 381 | 1 |
|
|
|
|
| 2 | 3 |
| Creta | 100 |
|
|
| 1 |
|
|
|
|
| Dolomita | 184 |
|
| 1 | 1 |
|
|
|
|
| Talco | 379 |
|
| 3 |
|
|
|
| 4 |
| Wollastonita | 116 |
|
|
| 1 |
|
|
| 1 |
| Colemanita | 411 |
|
|
| 2 |
|
| 3 |
|
| Frita 3221 | 125 |
|
|
| 1 |
|
| 1 |
|
| Frita 1510 | 198 | .65 | .05 |
| .1 | .2 | .05 |
| 2.1 |
| Nefelina sienita | 476 | .76 | .24 |
|
|
| 1.11 |
| 4.88 |
| Arcilla de bola | 258 |
|
|
|
|
| 1 |
| 2 |
(los frittes son provistos por Johnson/Matthey)
Método de trabajo:
Elegimos materias con una fórmula química simple y calculamos la cantidad de esos materiales para
conseguir (lo más aproximadamente posible) la receta buscada.
Nosotros utilizamos la fórmula Seger porque es el camino más sencillo. Para ilustrar este procedimiento, tomamos la receta
2) como ejemplo.Queremos obtener:
| Qué deseamos lograr: |
| material... | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
Primero elegimos la fuente de Na2O: tomemos la cantidad de .12 mol. de la frita 1451.
Para saber cuánto pesa el material buscado, multiplicamos .12 mol por el peso molecular de este material =.12*381=46 gramos
|
| material... | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
|
|
Como fuente de MgO hemos elegido Dolomita en cantidad de .16 mol, una complicación es que al mismo tiempo añadimos CaO
(pero estamos todavía por debajo de la cantidad total de CaO requerida, =.72) |
| material... | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Dolomita | 184 | 29 | .16 |
| .16 | .16 |
|
|
|
Ahora completaremos la cantidad de B2O3.La cantidad total es .59 mol pero con la frita 1451 ya hemos aportado la cantidad
de .24 así que queda un resto de de .35 mol.
Elegimos la colemanita y necesitamos .35/3=.12 mol(véase materiales: 1 mol de Colemanita proporciona 3 mol de B2O3 y 2 mol
de CaO) |
| material... | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Colemanita | 411 | 49 | .12 |
|
| .24 | .36 |
|
|
|
Ahora solo queda completar el CaO. Tendremos que añadir .32 mol de Creta (Carbonato de calcio). |
| material... | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Creta | 100 | 32 | .32 |
|
| .32 |
|
|
|
|
El resultado final es la suma de todos los aportes moleculares, la cual está en concordancia con la receta deseada. |
| material... | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Total |
|
|
| .12 | .16 | .72 | .60 | .36 |
|
Esto no es muy difícil, pero no siempre es posible llegar a una solución (especialmente cuando los materiales son más
complejos).
Intentamos hacer que los óxidos alcalino-térreos (Na2O K2O MgO CaO) sumen 1 .
En el curso de los experimentos el objetivo de “rehacer” exactamente el borato Gerstley fue abandonado y en su lugar
fijamos nuestra atención en el aspecto del vidriado. La fórmula Seger fue calculada cada vez, pero con el único propósito
de guiarnos al hacer cambios lógicos en las recetas.
Experimentos
 |
serie 1 - 4
1)
La mayor aproximación al borato Gerstley con las fritas 3221/1451.
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Creta | 100 | 21 | .21 |
|
| .21 |
|
|
| Dolomita | 184 | 29 | .16 |
| .16 | .16 |
|
|
| Frita 3221 | 125 | 44 | .35 |
|
| .35 | .35 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .16 | .72 | .59 | .36 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Este vidriado tiene burbujas de gas, claramente visibles en la fotografía de color azul.
El craquelado no está muy bien desarrollado.
|
 |
2)
La mayor aproximación al borato Gerstley con la frita 1451 y colemanita, los otros materiales son los mismos que
en 1).
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| creta | 100 | 32 | .32 |
|
| .32 |
|
|
| Dolomita | 184 | 29 | .16 |
| .16 | .16 |
|
|
| Colemanita | 411 | 49 | .12 |
|
| .24 | .36 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .16 | .72 | .60 | .36 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Este vidriado no fundió bien, el color es más pastoso. |
 |
3)
Los materiales fueron elegidos de tal manera que no emitieran CO2, como en el caso de la creta y la dolomita.
Se elige la colemanita como fuente de B2O3.
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 | 55 | .47 |
|
| .47 |
| .47 |
| Colemanite | 411 | 49 | .12 |
|
| .24 | .36 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .71 | .60 | 1.03 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Los dos nuevos materiales introducen más SiO2 y el vidriado desarrolla un pobre craquelado y funde mal.
|
 |
4)
Los mismos materiales que en 3) con más colemanita para conseguir una temperatura de fusión más baja.(La colemanita
es elegida como fuente de B2O3. )material peso mol peso Mol% Na2O MgO CaO B2O3 SiO2
(como colomanite de la fuente B2O3 se elige)
| material | molweight | weight | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonita | 116 | 37 | .33 |
|
| .33 |
| .33 |
| Colemanita | 411 | 82 | .20 |
|
| .40 | .60 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .73 | .84 | .89 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
La mayor cantidad de colemanita da al vidriado un mejor comportamiento al fundir.
En las series esta receta da los mejores resultados.
|
 |
serie 5 - 10
En las series 5-7 el contenido de la frita 3221 se ha incrementado y puesto que ésta es un borato de calcio, tenemos que
rebajar el contenido de wollastonita al mismo tiempo. (El contenido de Na2O, MgO, CaO es siempre el mismo).
El contenido de SiO2 desciende porque baja el contenido de Wollastonita.
5) Aumento del contenido de B2O3 con la frita 3221 como fuente. (B2O3=.64 mol)
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonita | 116 | 35 | .30 |
|
| .30 |
| .30 |
| Frita 3221 | 125 | 50 | .40 |
|
| .40 | .40 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | .64 | .86 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
6) Aumento del contenido de B2O3 con la frita 3221 como fuente.
(B2O3=.79 mol)
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonita | 116 | 18 | .15 |
|
| .15 |
| .15 |
| Frita 3221 | 125 | 68 | .55 |
|
| .55 | .55 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | .79 | .71 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
7) Aumento del contenido de B2O3 con la frita 3221 como fuente.
(B2O3=.97 mol)
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonita | 116 |
|
|
|
|
|
|
|
| Frita 3221 | 125 | 91 | .73 |
|
| .73 | .73 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .73 | .97 | .56 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
En esta serie el contenido de B2O3 ha aumentado por la colemanita (y no por la frita 3221).
El número 7 en las series da el mejor resultado. También aquí podemos ver como un mayor contenido de B2O3 da mejores
resultados.
El contenido de Na2O, MgO, CaO es siempre el mismo.
|
 |
De este serie el contenido BÒ3 ha aumentado en Colemanite (y no por el fritte 3221).
El contenido de Na20;, MgO, CaO es siempre igual.
8) Aumento de contenido de B2O3 con la colemanita como fuente. (B2O3=.99 mol)
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonita | 116 | 23 | .20 |
|
| .20 |
| .20 |
| Colemanita | 411 | 102 | .25 |
|
| .50 | .75 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | .99 | .76 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
9)
Aumento del contenido de B2O3 con la colemanita como fuente. (B2O3=1.14 mol)
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonita | 116 | 12 | .10 |
|
| .10 |
| .10 |
| Colemanita | 411 | 123 | .30 |
|
| .60 | .90 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | 1.14 | .66 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
10) Aumento del contenido de B2O3 con la colemanita como fuente.
(B2O3=1.29 mol)
| materiate 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonita | 116 |
|
|
|
|
|
|
|
| Colemanita | 411 | 144 | .35 |
|
| .70 | 1.05 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | 1.29 | .56 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
En las series 5-10 el contenido de colemanita ha sido aumentado, al mismo tiempo el contenido de wollastonita ha sido
rebajado hasta cero. (El contenido de Na2O, MgO, CaO es siempre el mismo).
Al aumentar el contenido de colemanita la cantidad de burbujas de gas también aumenta como se puede ver por las picaduras
en el vidriado.
El mejor resultado de la serie lo da el número 7.
|
 |
serie 11 - 13
Estudio de la influencia de la frita 1451 (y así del contenido de Na2O)
11) NaO=.06 mol%
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 | 23 | .06 | .06 |
|
| .12 | .18 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Colemanita | 411 | 164 | .40 |
|
| .80 | 1.20 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .06 | .15 | .80 | 1.32 | .38 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
12) Na2O=0 mol
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1451 | 381 |
|
|
|
|
|
|
|
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Colemanita | 411 | 172 | .42 |
|
| .84 | 1.26 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
|
| .15 | .84 | 1.26 | .20 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
13) Na2O=.13 mol
Reducción a cero del contenido de frita 1451, pero usando ahora la frita 1510 como fuente de Na2O.
( .13 mol Na2O, la misma que en el exp.10)
Este experimento se llevó a cabo para ver si las picaduras -por usar colemanita – fueron causados por la baja temperatura
de fusión de la frita 1451.
(El bajo punto de fusión de uno de los componentes puede tener efecto sobre la evaporación del agua presente en la colemanita - 2CaO.3B2O3.2H2O -)
(El resultado del experimento 12) no fue conocido, así que este resultado
podría aclarar que el comportamiento en la fusión de la frita 1451 no tuvo nada que ver.
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Frita 1510 | 198 | 40 | .2 | .13 |
| .02 | .04 |
| .42 |
| Talco | 379 | 19 | .05 |
| .15 |
|
|
| .20 |
| Colemanita | 411 | 144 | .35 |
|
| .70 |
| 1.05 |
|
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .13 | .15 | .72 | .04 | 1.05 | .62 |
| GB RR |
|
|
| .12 | .16 | .72 |
| .59 | .33 |
Los vidriados son bastante malos en general con muchas picaduras, hay un montón de burbujas de gas durante la quema.
|
 |
serie 14 - 16
En el experimento 12) el contenido de Na2O ha sido rebajado a cero y éste
no tiene influencia en los resultados, así también la cantidad de MgO ha sido disminuida para ver lo que sucede.
Usamos la colemanita y también la frita 3221 como fuente de B2O3.
14) el contenido del talco en la receta 12) es ahora 0.
| material | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Talco | 379 |
|
|
|
|
|
|
|
| Colemanita | 411 | 206 | .50 |
|
| 1.0 | 1.50 |
|
| Frita 3221 | 125 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
|
|
| 1.0 | 1.5 |
|
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
15) “misma” receta de 12) ahora con la frita 3221 como fuente de B2O3, colemanita = 0
| materiaal | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Talco | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Colemanita | 411 |
|
|
|
|
|
|
|
| Frita 3221 | 125 | 106 | .85 |
|
| .85 | .85 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
|
| .15 | .85 | .85 | .20 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
16) igual que 15) ahora sin talco.
| materiaal | peso mol | peso | Mol% | Na2O | MgO | CaO | B2O3 | SiO2 |
| Talk | 379 |
|
|
|
|
|
|
|
| Colemaniet | 411 |
|
|
|
|
|
|
|
| Fritte 3221 | 125 | 125 | 1.0 |
|
| 1.0 | 1.0 |
|
|
|
|
|
|
|
|
|
|
| Totaal |
|
|
|
|
| 1.0 | 1.0 |
|
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
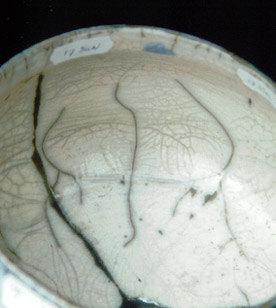
El resultado de los experimentos 15-16 son los mejores, no hay desprendimiento de gas durante la quema y esa es la razón
por la que no hay picaduras en el vidriado.
El experimento 14, sólo con colemanita, produce un montón de gas y picaduras y un craquelado bastante malo.
El uso de la colemanita en vidriados de Raku no es una buena elección! (aunque el precio del material sea bajo.)
Una adición especial de Na2O, MgO, CaO no es necesaria cuando usamos nefelina sienita !!
|
 |
serie 17 - 19
Ahora que sabemos que sólo con la frita 3221 y nefelina sienita es posible conseguir u buen vidriado, queremos examinar si
la proporción entre los dos materiales (hasta ahora siempre en una razón de peso de 1:1) tiene un efecto destacado en los
resultados.
También el grosor de la capa de vidriado es una parte del experimento.(capa fina /gruesa)
17) proporción 3221 : NS = 8 : 12
La capa fina produce mejor craquelado.
|
 |
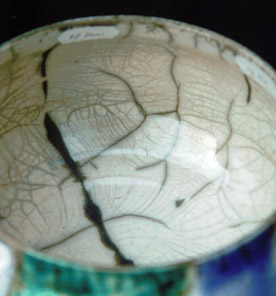
18) 18) proporción 3221 : NS = 10 : 10
(capa fina /gruesa)La capa fina produce mejor craquelado.
|
 |
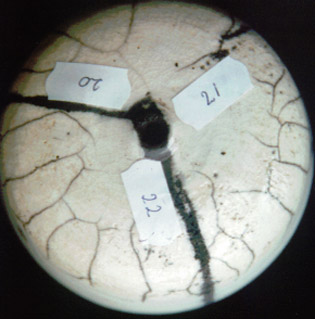
19)
proporción 3221 : NS = 12 : 8 (capa fina /gruesa)
La capa fina produce mejor craquelado.
Conclusión: La capa fina produce mejor craquelado que la capa espesa.
Hay poca diferencia en la razón entre la frita 3221 y la nefelina sienita,
los experimentos 17/18 son un poco mejores que el 19 y afortunadamente más baratos también !!
|
 |
serie 20 - 22
La receta recién descubierta es tan buena como sencilla, sin embargo es difícil de extender y
así la posibilidad de aplicar el vidriado a brocha no es la mejor.
En esta serie se añade ball clay (arcilla de bolas) para mejorar la aplicación.
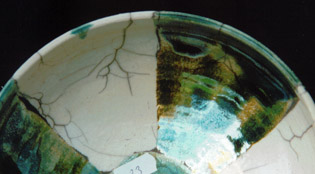
| material | exp. 20 | exp. 21 | exp. 22 |
| frita 3221 | 10 | 10 | 10 |
| nefelina sienita | 10 | 9 | 8 |
| ball clay |
| 1 | 2 |
p> En la formación de craquelado no hay gran diferencia entre las recetas.
En el experimento 22) la capacidad de aplicación con brocha (e icluso la dureza de la capa del vidriado) es comparable
con el borato Gerstley (el cual es excelente para aplicar a brocha).
|
 |
Serie 23 - 25
En una tentativa de hacer la receta complicó más (usted es alquimista o no.) He jugado de con algunas adiciones
de Na20; en la forma la sal (NaCl) o la soda (NaHCO3.H20;).
En un intento de hacer la recta más complicada (eres un alquimista o no.) He jugado con algunas adiciones de Na2O en forma
de sal común (NaCl) o carbonato de sodio (NaHCO3.H2O).
De arriba abajo:exp.23) igual receta que 22) exp.24) adición de 1 de sal común (naCl)exp 25) adición de 1 gramo de
carbonato de sodio (NaHCO3.H2O)
De tapa al fondo:
exp. 23) el mismo recepee que 22)
exp. 24) 1 adición del gramo de la sal (naCl)
exp. 25) 1 adición del gramo de la soda (NaHCO3.H20;)
No hay diferencia en los resultados, lástima? No! porque la simplicidad es también hermosa.
|
 |
 |
Conclusión:
Al principio traté de “rehacer” el borato Gerstley con una combinación de materias que proporcionan la misma fórmula química.
Esto se puede realizar con la adición de: frita 1451, dolomita, creta, frita 3221 (o colemanita).
Las burbujas de gas formadas durante la quema del vidriado son producidas por la descomposición del CO2
(creta / dolomita) o del H2O (colemanita).
Esto se puede prevenir udo wollastonita y talco como fuente de CaO y MgO (aunque entonces se aporta SiO2 extra).
La frita de borato de calcio 3221 (Johnson/Matthey) es muy interesante como fuente de B2O3 y es mucho mejor que la
colemanita (picaduras).
En los experimentos se puede ver que sólo la nefelina sienita y la frita 3221 son muy útiles.
La posibilidad de aplicación con brocha del vidriado es mejorada con la adición de ball clay a expensas de la
nefelina sienita.
La receta final es sorprendentemente simple:
| Frita 3221 | 100 gramos |
| nefelina sienita | 80 gramos |
| ball clay | 20 gramos |
Objetos hechos con la receta del final |
 |
|

















