 |
série 1 - 4
1)
L'approche la plus précise du borate de Gerstley avec les frittes 3221/1451.
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Carb. de calcium | 100 | 21 | .21 |
|
| .21 |
|
|
| Dolomite | 184 | 29 | .16 |
| .16 | .16 |
|
|
| Fritte 3221 | 125 | 44 | .35 |
|
| .35 | .35 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .16 | .72 | .59 | .36 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Cette glaçure donne des bulles de gaz, clairement visibles sur la photo avec la couleur bleue.
Les craquelés ne sont pas très bien développés .
|
 |
2)
L'approche la plus précise du Gerstley borate avec la fritte 1451 et la colémanite, les autres matériaux
sont identiques à
1)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Carb. de calcium | 100 | 32 | .32 |
|
| .32 |
|
|
| Dolomite | 184 | 29 | .16 |
| .16 | .16 |
|
|
| Colemaniet | 411 | 49 | .12 |
|
| .24 | .36 |
|
|
|
|
|
|
|
|
|
|
| Totaal |
|
|
| .12 | .16 | .72 | .60 | .36 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Cette glaçure n'a pas bien fondue, la couleur bleue est plus terne.
|
 |
3)
Les matériaux ont été choisis pour qu'il n'y ai pas de formation de CO2, comme dans le cas ou on a employé du
carbonate de calcium ou de la dolomite. La Colémanite a été choisie comme source de B2O3.
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 | 55 | .47 |
|
| .47 |
| .47 |
| Colémanite | 411 | 49 | .12 |
|
| .24 | .36 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .71 | .60 | 1.03 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Les deux nouveaux matériaux introduisent plus de SiO2 et la glaçure donne un craquelé faible et fond mal.
|
 |
4)
Les mêmes matériaux que 3) avec plus de colémanite pour baisser la température
de fusion. (comme source de B2O3 la colémanite est choisie)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 | 37 | .33 |
|
| .33 |
| .33 |
| Colémanite | 411 | 82 | .20 |
|
| .40 | .60 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .73 | .84 | .89 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
La quantité plus importante de colémanite donne à cette glaçure un meilleur comportement à la fusion.
Dans cette
série la recette donne les meilleurs résultats.
|
 |
série 5 - 10
Dans la série 5-7 la quantité de fritte 3221 a été augmenté et parce que c'est un borate de la Californie nous devons
abaisser la quantité de walloniste en même temps. (la quantité de Na2O, MgO, CaO est toujours identique).
La teneur de SiO2 diminue parce que la quantité de Wollastonite diminue.
5) Augmentation du B2O3 avec la fritte 3221 comme source. (B2O3=0,64 mole)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 | 35 | .30 |
|
| .30 |
| .30 |
| Fritte 3221 | 125 | 50 | .40 |
|
| .40 | .40 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | .64 | .86 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
6) Augmentation du B2O3 avec la fritte 3221 comme source.(B2O3=0,79 mole)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 | 18 | .15 |
|
| .15 |
| .15 |
| Fritte 3221 | 125 | 68 | .55 |
|
| .55 | .55 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | .79 | .71 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
7) Augmentation du B2O3 avec la fritte 3221 comme source.(B2O3=0,97 mole)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 |
|
|
|
|
|
|
|
| Fritte 3221 | 125 | 91 | .73 |
|
| .73 | .73 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .73 | .97 | .56 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Le numéro 7 de la série donne le meilleur resultat. Ainsi ici nous pouvons voir qu'une teneur plus élevée de B2O3 donne
de meilleurs résultats.
|
 |
Dans cette série le B2O3 est augmenté par la colémanite (et non par la fritte 3221). Le Na2O,MgO,CaO
est toujours identique série 5 - 7
8) ) Augmentation du B2O3 avec la colémanite comme source. (B2O3=0,99 mole)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 | 23 | .20 |
|
| .20 |
| .20 |
| Colémanite | 411 | 102 | .25 |
|
| .50 | .75 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | .99 | .76 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
9)
Augmentation du B2O3 avec la colémanite comme source. (B2O3=1,14 mole)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 | 12 | .10 |
|
| .10 |
| .10 |
| Colémanite | 411 | 123 | .30 |
|
| .60 | .90 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | 1.14 | .66 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
10)
Augmentation du B2O3 avec la colémanite comme source. (B2O3=1,29 mole)
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 46 | .12 | .12 |
|
| .24 | .36 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Wollastonite | 116 |
|
|
|
|
|
|
|
| Colémanite | 411 | 144 | .35 |
|
| .70 | 1.05 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .12 | .15 | .70 | 1.29 | .56 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Dans la série 5-7 la quantité de colémanite a été augmentée, en même temps la quantité de la wallastonite s'est abaissé
à zéro. (la teneur de Na2O, MgO, CaO est toujours identique)
En augmentant la quantité de colémanite, la quantité de bulles de gaz augmente également comme vous pouvez le voir
par la présence de trous d'épingle dans la glaçure.
Le numéro 7 de la série donne le meilleur résultat.
|
 |
série 11 - 13
Étude de l'influence de la fritte 1451 (et de la quantité de Na2O)
11) NaO=.06 mol%
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 | 23 | .06 | .06 |
|
| .12 | .18 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Colémanite | 411 | 164 | .40 |
|
| .80 | 1.20 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .06 | .15 | .80 | 1.32 | .38 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
12) ) Na2O=0 mole
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Fritte 1451 | 381 |
|
|
|
|
|
|
|
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Colémanite | 411 | 172 | .42 |
|
| .84 | 1.26 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
|
| .15 | .84 | 1.26 | .20 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
13) Na2O=0,13 mole
Diminution de la quantité de fritte 1451 à zéro, mais maintenant la fritte 1510 est la source de Na2O. 0,13 mole Na2O
(le même que dans expérience.10)
Cette expérience est effectuée pour voir si les trous d'épingle, en employant la colémanite étaient provoqués par
la basse température de fusion de la fritte 1451.
(Le bas point de fusion d'un des composants peut avoir un effet sur l'évaporation de l'eau normalement présente dans
la colémanite ( 2CaO.3B2O3.2H2O )
(Le résultat de l'expérience 12) n'est pas connu, autrement ce résultat préciserait le comportement de fusion de la
fritte 1451, elle n'a aucune influence).
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | ZnO | B2O3 | SiO2 |
| Fritte 1510 | 198 | 40 | .2 | .13 |
| .02 | .04 |
| .42 |
| Talc | 379 | 19 | .05 |
| .15 |
|
|
| .20 |
| Colémanite | 411 | 144 | .35 |
|
| .70 |
| 1.05 |
|
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
| .13 | .15 | .72 | .04 | 1.05 | .62 |
| GB RR |
|
|
| .12 | .16 | .72 |
| .59 | .33 |
Les glaçures sont plutôt mauvaises avec en général beaucoup de trous d'épingle.
Il y a beaucoup de bulles de gaz pendant la cuisson.
|
 |
série 14 - 16
Dans l'expérience 12) la quantité de Na2O a été abaissé à zéro et ceci n'a aucune influence sur les résultats,
par conséquent la quantité de MgO a été diminué pour voir ce qui se passe.
C’est aussi bien avec de la colémanite qu’avec la fritte 3221 comme source de B2O3.
14) La quantité de talc dans la recette
12) est maintenant à 0.
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Talc | 379 |
|
|
|
|
|
|
|
| Colémanite | 411 | 206 | .50 |
|
| 1.0 | 1.50 |
|
| Fritte 3221 | 125 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
|
|
| 1.0 | 1.5 |
|
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
15) “ même ” recette que
12) maintenant avec la fritte
3221 comme source de B2O3, colémanite=0
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Talc | 379 | 19 | .05 |
| .15 |
|
| .20 |
| Colémanite | 411 |
|
|
|
|
|
|
|
| Fritte 3221 | 125 | 106 | .85 |
|
| .85 | .85 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
|
| .15 | .85 | .85 | .20 |
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
|
 |
16) Idem 15)
maintenant sans talc.
| matériaux | Poids molaire | poids | % molaire | Na2O | MgO | CaO | B2O3 | SiO2 |
| Talc | 379 |
|
|
|
|
|
|
|
| Colémanite | 411 |
|
|
|
|
|
|
|
| Fritte 3221 | 125 | 125 | 1.0 |
|
| 1.0 | 1.0 |
|
|
|
|
|
|
|
|
|
|
| Total |
|
|
|
|
| 1.0 | 1.0 |
|
| GB RR |
|
|
| .12 | .16 | .72 | .59 | .33 |
Les résultats des expériences 15-16 sont les meilleurs, il n'y a pas de formation de gaz pendant la cuisson et c'est
la raison pour laquelle il n'y a pas de trou d'épingle dans la glaçure.
L'expérience 14, avec seulement la colémanite, donne beaucoup de gaz, de trous d'épingle et un craquelé plutôt mauvais.
L'utilisation de la colémanite dans des glaçures de Raku n'est pas un bon choix! (bien que le prix du matériau soit bas.)
Une addition spéciale de Na2O, MgO, CaO n'est pas nécessaire quand nous employons la néphéline syénite !!
|
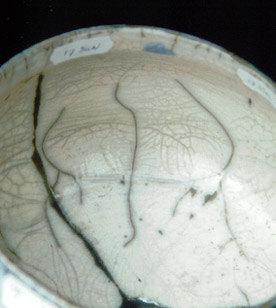 |
série 17 - 19
Maintenant que nous savons qu’avec seulement la fritte 3221 et la néphéline syénite il est possible de faire une
bonne glaçure nous voulons examiner si le ratio entre les deux matériaux (jusqu' à maintenant toujours dans le rapport
de poids 1:1) a un effet prononcé sur les résultats.
Ainsi que l'épaisseur de la couche est l’intérêt de l'expérience.
17) ratio 3221:NS = 8: 12 (couche mince / couche épaisse).
Les couches minces donnent un meilleur craquelé.
|
 |
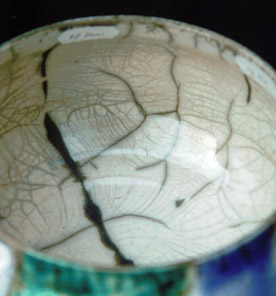
18) ratio 3221:NS = 10:10 (couche mince / couche épaisse).
Les couches minces donnent un meilleur craquelé.
|
 |
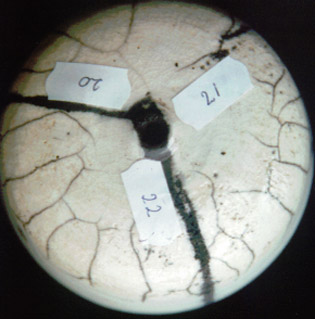
19) ratio 3221 :NS = 12:8 (couche mince / couche épaisse).
Les couches minces donnent de meilleurs craquelés.
Conclusion: les couches minces donnent un meilleur craquelé que les couches épaisses.
Lorsqu’il y a une petite différence entre le ratio de la fritte 3221 et la néphéline syénite, l'expérimentation 17/18 est
un peu meilleure que la 19 et heureusement il est meilleur marché aussi!!
|
 |
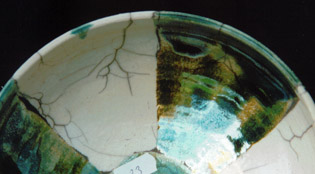
série 20 - 22
La recette trouvée jusqu'ici est bonne et simple, toutefois il est difficile l’étaler et ainsi la possibilité d’appliquer
la glaçure avec une brosse n'est pas optimale.
Dans cette série l’argile est ajoutée pour améliorer la viscosité.
| matériaux | pr 20 | pr 21 | pr 22 |
| fritte 3221 | 10 | 10 | 10 |
| Néphéline syénite | 10 | 9 | 8 |
| ball clay |
| 1 | 2 |
Pour la formation des craquelés il n'y a pas une grande différence de recette.
L’essai 22,.la viscosité (et également l’épaisseur de la couche) est comparable au Gerstley borate (qui est facile a
appliquer avec une brosse).
|
 |
série 23 - 25
Afin d'essayer de faire la recette plus compliquée (vous êtes un alchimiste ou pas.)
J'ai joué avec quelques additions de Na2O sous forme de sel (NaCl) ou de soude (NaHCO3.H2O).
De haut en bas:
exp.23) même recette que 22)
exp.24) addition de 1 gramme de sel (naCl))
exp. 25) addition de 1 gramme de soude (NaHO3.H2O)
Là n'y avait-il pas une différence dans les résultats, pitié? Non! parce que la simplicité est également belle.
|
 |
 |























